5. Clasifica las siguientes características según se
correspondan a los sólidos, a los líquidos o a los gases:
- MÉTODO CIENTIFICO.
- COMPOSICIÓN DE LA MATERIA.
- ÁTOMO (Teoría Atómica).
¿Qué diferencia hay entre hipótesis, ley y teoría en la ciencia?
Las teorías son una explicación amplia para una variedad de fenómenos e incluyen muchas hipótesis y leyes.
Por ejemplo, cuando se hablaba de la evolución, Jean-Baptiste Lamarck (Bazentin, 1744 - París, 1829) decía: el medio es el que hace que los seres vivos cambien porque usan o dejan de usar algunas de sus características, con lo cual el medio es el que hace que los seres se transformen. Y ponía el clásico ejemplo de la jirafa. A la jirafa se le estira el cuello, pensaba Lamarck, porque como las ramitas que va a comer están en los árboles que son altos, su cuello se va estirando de tanto usarlo para alcanzarlas. Luego viene Charles Darwin (Shrewsbury, 1809-Down House, 1882) y dice, no, no creo que sea así, yo creo que los organismos sufren pequeños cambios que consiguen que cuando ocurre una transformación en el medio ambiente (externo o interno) les permiten adaptarse a esa novedad; sobrevivir y producir mayor cantidad de descendientes. Entonces su población aumentará a expensas de otras menos capaces de adaptarse a las nuevas circunstancias. Un observador externo lo ve como si los organismos hubieran sido seleccionados por acción directa del ambiente pero en realidad ha sido la condición de los organismos de tener variación y diversidad lo que les ha dado las oportunidades para adaptarse a los cambios, sobrevivir y, a la larga, evolucionar.
Hoy en día tenemos una teoría unificada que reúne las observaciones de Lamarck y de Darwin, las del genetista Gregor Mendel y más recientemente las observaciones de la genética molecular y la epigenética para explicar tanto la diversidad de los organismos que les permite adaptarse a nuevos cambios del ambiente como el impacto que los cambios tienen sobre los mecanismos genéticos que en la época de Darwin y Lamarck no se conocían.
Una ley es una manera de generalizar lo que puede ocurrir cuando tienes un conjunto acumulado de datos sobre un fenómeno determinado
En ese proceso de dar explicaciones para fenómenos surge muchas veces una concordancia o una generalización sobre los datos que uno tiene. Por ejemplo, si volvemos al ejemplo de la evolución, parece que siempre sobreviven los organismos que tienen las características que les permiten adaptarse a determinado ambiente. Cuando eso se encuentra en la ciencia, una manera compacta de describir un fenómeno, es decir de predecir qué es lo que va a suceder en una situación determinada, es una ley. Por ejemplo, la ley de la selección natural que dice: siempre sobreviven los individuos más aptos. Ahí se describe un hecho que se ha ido construyendo con las distintas hipótesis de las que se partía. Esa ley no te explica todo el proceso evolutivo pero sí te dice una manera de generalizar lo que puede ocurrir cuando tienes un conjunto acumulado de datos sobre un fenómeno determinado.
Las leyes científicas pueden ser modificadas o rechazadas. Hubo un tiempo en el que se creía que la vida surgía por generación espontánea, por ejemplo, pero el avance del conocimiento llevó a que esa idea se rechazara. Por último, surgen las teorías que son la construcción más compleja que elabora la ciencia. Por eso el sueño de las personas que se dedican a la ciencia y de la ciencia en general son las teorías unificadas porque son como súper teorías, súper construcciones de conocimiento que resumen toda la biología o toda la física o toda un área de la matemática o de la química.
Una nueva evidencia o una nueva forma creativa de observar el fenómeno del que trata una teoría puede hacer que se formule una nueva hipótesis
En física y en química se utilizan mucho las leyes. En biología, por la propia naturaleza del conocimiento científico, más que leyes se suelen hacer construcciones conceptuales más complejas como las teorías. Las teorías son una explicación amplia para una variedad de fenómenos e incluyen muchas hipótesis y leyes. Y deben tener una serie de características estructurales: deben ser concisas, deben ser sistemáticas, deben ser predictivas y deben ser aplicables de manera amplia. Generalmente, una teoría sobre un fenómeno determinado que es aceptada por la comunidad científica tiene muchas líneas de evidencia por lo que falsarlas, es decir, cambiarlas por otras, es difícil. Son muy estables. Pero eso no quiere decir que sean inmutables. Una nueva evidencia o una nueva forma creativa de observar el fenómeno del que trata una teoría puede hacer que se formule una nueva hipótesis y esa nueva hipótesis puede llegar a modificar la teoría.
La Materia y sus propiedades


Definición de materia
Una silla, por ejemplo, ocupa un sitio en el espacio, se puede tocar, se puede sentir, se puede medir, etc. Para que otro objeto pueda ocupar el lugar de la silla; lógicamente, debemos cambiarla de sitio.
Y…¿qué forma la materia?...pues los átomos. Tomemos por ejemplo una pared; está formada por bloques, los bloques están formados por arena, cemento y piedras pequeñas. Si nos fijamos en un granito de arena, este se compone de otras partículas minúsculas llamadas moléculas que están formadas por grupos de átomos.
La fuerza entre los átomos es la razón por la cual el agua cambia de estado. Si la fuerza entre sus átomos es grande, el agua es sólida como el hielo. Si la fuerza entre sus átomos es débil, el agua se convierte en vapor.
Cuando un átomo se rompe o se divide, produce muchísimo calor y luz. La energía atómica.
 | El átomo es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos. Elementos y Compuestos El agua es un compuesto, porque dentro de cada una de sus moléculas tiene 2 tipos de átomos diferentes, oxigeno e hidrógeno. La madera también tiene varios tipos de elementos en su interior. |
El oxígeno sólo tiene moléculas y átomos iguales entre sí, por lo tanto lo consideramos un elemento. Lo mismo le sucede al plomo y al oro.
 | La molécula es un conjunto de átomos iguales o diferentes, unidos por enlaces químicos, que constituyen la mínima porción de una sustancia que puede separarse sin alterar sus propiedades. |
Propiedades extrínsecas (extensivas o generales)
Propiedades intrínsecas (intensivas o específicas)
Otras propiedades de la materia
- Físicas: son aquellas en las que se mantienen las propiedades originales de la sustancia, ya que sus moléculas no se modifican.
- Químicas: son aquellas en las que las sustancias se transforman en otras, debido a que los átomos que componen las moléculas se separan formando nuevas moléculas.
¿Cómo medir la materia?
Se llaman magnitudes aquellas propiedades que pueden medirse y expresarse en números. Son magnitudes la longitud, masa, volumen, etc.
Masa
 | Es la cantidad de materia que tiene un cuerpo. Es más difícil empujar un camión que un vehículo pequeño. La cantidad de masa hace la diferencia. El camión tiene más masa y es más difícil de empujar. |
Longitud
 | Es la distancia entre dos puntos. La distancia se mide con una regla, una cinta de medir u otros dispositivos de medición con láser, etc… Cuando mides es muy importante decir que unidad usas. Por ejemplo, si dices que mediste 23 todos nos preguntaremos ¿23 qué; centímetros, milímetros, kilómetros? A estos los llamamos “unidades” sin ellas, los números solos no tienen ningún sentido. |
Volumen
 | Es una magnitud definida como el espacio ocupado por un cuerpo. Para conocer el volumen de un cuerpo, simplemente multiplicamos su ancho por su largo y luego por su alto. Es una función derivada, ya que se obtiene multiplicando las tres dimensiones. Su unidad de medida es el metro cúbico (m3), aunque temporalmente también acepta el litro, que se utiliza comúnmente en la vida práctica. |
Vamos a suponer que tenemos una tonelada de algodón y una tonelada de acero, ¿cuál de ambos ocupa el mayor volumen? La respuesta es el algodón, se necesita grandes cantidades para completar una tonelada. Es la densidad quien hace la diferencia en el volumen.
El acero es más denso que el algodón, es decir, se necesita menos material para completar la tonelada.
La densidad de una sustancia se relaciona con la cantidad de masa contenida en un determinado volumen. La representaremos con la letra griega , la masa queda representada por la letra “m” y “V” el volumen.
La densidad de un cuerpo está relacionada con su capacidad de flotar. Un cuerpo flotará si su densidad es menor que la de la sustancia, por eso la madera flota sobre el agua y el plomo se hunde en ella. El plomo posee mayor densidad que el agua y la densidad de la madera es menor.
Las unidades de medida de la densidad son el kg/m3, que se lee “kilogramo sobre metro cúbico” o un sub-múltiplo como g/cm3. Para calcular la densidad debemos medir la masa y el volumen, luego dividimos la masa entre el volumen y el resultado debe quedar expresado en kg/m3.
En la tabla que te presentamos puedes comparar algunas densidades:
Las sustancias con grandes densidades se les llama pesadas, ejemplo de estas son los metales. A las sustancias con densidades pequeñas se les llama ligeras, aquí entran el aire y otros gases.
El peso
 | La fuerza de gravedad sobre un objeto es llamada peso. Peso y masa no es lo mismo. Una bola de acero con una masa de 10 kilogramos no pesa igual en la tierra y en la luna. Como notamos tendrá la misma masa pero el peso es diferente. La luna tiene una fuerza de atracción mucho menor que la tierra, por lo que la bola pesará menos en el satélite. El peso de los objetos se debe a que la tierra, los atrae con su poderosa fuerza de atracción. La unidad de medida del peso es el newton. Comúnmente las personas confunden la masa con el peso. Es fácil confundirnos porque mientras más masa, mayor es la fuerza de atracción. Recuerda, al estudiar física, el peso depende de la gravedad y se mide en Newtons. |
Para calcular el peso de un objeto simplemente medimos su masa y la multiplicamos por la fuerza de gravedad (9.8 newtons/kilogramo) en la tierra. En la luna la fuerza de atracción es 6 veces menor, con una magnitud de 1.6 n/kg.
El tiempo
¿Por qué el tiempo? ¿Sirve el tiempo para medir la materia?
Una manera de medir el tiempo es el formato de fechas. Por ejemplo: en 2009 el verano inició el 21 de marzo a las 11:23 p.m. indicando un momento del tiempo.
A menudo, los científicos y los deportistas necesitan medir cantidades de tiempo. Cuando decimos: “9 minutos y 8 segundos” (00:09:08) estamos especificando una cantidad de tiempo.
Un cronómetro mide intervalos o cantidades de tiempo, tiene un botón para iniciar y detener el conteo. La pantalla presenta el tiempo en segundos en un máximo de 60.
El tiempo se presenta en el formato min:seg cuando se cuentan más de 60 segundos.
Muchas veces los científicos y quienes hacen experimentos miden el tiempo en segundos, sin embargo el tiempo normalmente se expresa en unidades de tiempo mezcladas que incluyen horas, minutos y segundos.
Llamamos estado a la manera en que se presenta la materia. Estos pueden ser:
 | Sólido, tiene una forma definida, como la madera y el cobre. Sus moléculas no cambian de posición. Líquido, no tiene una forma definida, como el agua y el aceite. Sus moléculas pueden cambiar de posición. Gaseoso, no tiene una forma definida, como el aire y el vapor de agua. Sus moléculas cambian libremente de posición. |
La era atómica comenzó en 1808, cuando un profesor de escuela presentó sus ideas respecto a cómo debían ser las partículas más pequeñas de materia.
El modelo atómico de Dalton fue expuesto en un libro llamado “Nuevo sistema de filosofía química”, y en síntesis decía lo siguiente:
- La materia está formada por partículas pequeñísimas llamadas “átomos”.
- Estos átomos no se pueden dividir ni romper, no se crean ni se destruyen en ninguna reacción química, y nunca cambian.
- Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa y dimensiones; por ejemplo, todos los átomos de hidrógeno son iguales.
- Por otro lado, los átomos de elementos diferentes, son diferentes; por ejemplo, los átomos de oxígeno son diferentes a los átomos de hidrógeno.
- Los átomos pueden combinarse para formar compuestos químicos. Por ejemplo, los átomos de hidrógeno y oxígeno pueden combinarse y formar moléculas de agua.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto. Por ejemplo, un átomo de carbono con uno de oxígeno forman monóxido de carbono (CO), mientras que dos átomos de oxígeno con uno de carbono, forman dióxido de carbono (CO2)
La naturaleza de los rayos canales varia de acuerdo al tipo de gas residual que se encuentre en el tubo, es decir, cada elemento químico gaseoso genera un catión distinto al ionizarse y por ello su relación carga – masa (e/m) es diferente.El físico alemán Wilhelm OEIN (1898), luego de realizar experiencias con los rayos canales generados por el gas hidrogeno, de manera análoga a Thomson, midió la relación carga-masa de los iones positivos y encontró que la carga positiva era igual a la carga del electrón (en magnitud) y su masa igual a 1836 veces al del electrón; dicha partícula se llamo protón (H+).
Luego del descubrimiento del electrón en 1897 por Joseph John Thomson, se determinó que la materia se componía de dos partes, una negativa y una positiva. La parte negativa estaba constituida por electrones, los cuales se encontraban según este modelo inmersos en una masa de carga positiva a manera de pasas en un pastel (de la analogía del inglés plum-pudding model) o uvas en gelatina.
Este modelo fue desarrollado por el físicoPodemos decir que la mecánica cuántica moderna surge hacia 1.925 como resultado del conjunto de trabajos realizados por Heisenberg, Schrödinger, Born, Dirac y otros, y es capaz de explicar de forma satisfactoria no sólo,la constitución atómica, sino otros fenómenos fisicoquímicos, además de predecir una serie de sucesos que posteriormente se comprobarán experimentalmente.
La mecánica cuántica se basa en la teoría de Planck, y tomo como punto de partida la dualidad onda-corpúsculo de Louis De Broglie y el principio de incertidumbre de Heisenberg :
1.Hipótesis de Louis De Broglie, publicada en 1923.
La naturaleza de la luz no es fácilmente analizable a no ser que la consideremos de tipo ondulatorio a fin de explicar ciertos fenómenos (como reflexión, refracción, difracción, etc.) o de tipo corpuscular al pretender hacerlo con otros (como el efecto fotoeléctrico, etc), ¿es posible que las partículas tengan también propiedades de onda?.
En 1924 Louis De Broglie extendio el carácter dual de la luz a los electrones, protones, neutrones, átomos y moléculas, y en general a todas las partículas materiales. Basandose en consideraciones relativostas y en la teoría cuántica pensó que si la luz se comportaba como onda y como partícula la materia debería poseer este carácter dual.
El movimiento de una partícula puede considerarse como el movimiento de un paquete de ondas, algo así como la superposición de varias ondas de longuitudes de onda poco diferentes, cuyas oscilaciones se intensifican al máximo en el punto del espacio ocupado popr la partícula. No hay nada de imaginario en estas ondas de materia, son tan reales como las ondas luminosas y las del sonido, aunque no sean observables en todos los casos, copmo ocurre con las ondas electromagnéticas, los aspectos ondulatorios y de partículas de los cuerpos en movimiento nunca se pueden observar al mismo tiempo.
En ciertas situaciones una partícula en movimiento presenta propiedades ondulatorias y en otras situaciones presenta propiedades de partícula
2.Principio de incertidumbre de Heisenberg, publicada en el 1.927
Uno de los aspectos más importantes de la mecánica cuantica es que no es posible determinar simultaneamente , de un modo preciso, la posición y la cantidad de movimiento de una partícula. Esta limitación se conoce con el nombre de principio de incertidumbre o de indeterminación de Heisenberg.
El principio de incertidumbre es una consecuencia de la dualidad onda-partícula de la radiacción y de la materia. Todos los objetos, independientemente de su tamaño, estan regidos por el principio de incertidumbre, lo que significa que su posición y movimiento se pueden expresar solamente como probabilidades, pero este principio sólo es significativo para dimensiones tan pequeñas como las que presentan las partículas elementales de la materia. Este principio carece de interés en mecánica clásica, ya que las magnitudes involucradas son muy grandes comparadas con el valor de la constante h.
3.Descripción del modelo mecanico-cuántico del átomo. La ecuación de onda de Schrödinger, publicada en 1.926
Basándose en la hipótesis de L. De Broglie aplicabla al átomo de hidrógeno, designada por el simbolo( y), llamada función de onda, es función de las coordenadas cartesianas x, y, z; E y V.
- Orbitales "s": Los orbitales "s" son esféricamente simétricos.
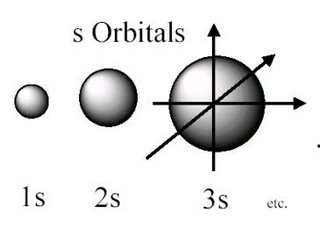
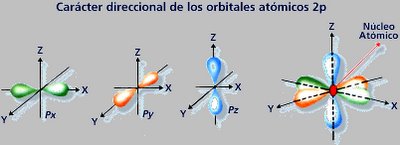
- Orbitales "f": Son orbitales de mayor energía. Para n=4,I=3 y tendremos 7 orbitales f ( ml=-3,-2,-1,0,1,2,3) . Los orbitales f son importantes para comprender el comportamiento de los elementos con número atómico mayor a 57.
Para átomos con más de un electrón (polielectrónicos) los orbitales atómicos tienen la misma forma que los orbitales del átomo de hidrógeno, pero la presencia de más de un electrón afecta a los niveles de energía de los orbitales (debido a la repulsión entre dos electrones).
Así por ejemplo el orbital 2s tienen un valor de energía menor que los orbitales 2p para átomos con más de un electrón:
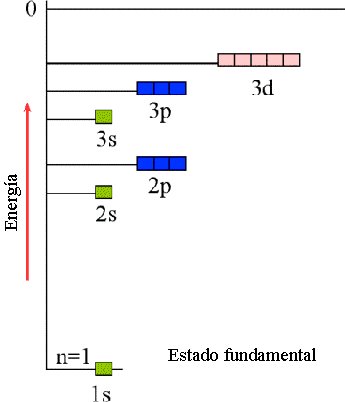
La figura anterior representa el orbital de mínima energía del átomo de hidrógeno. Mientras que el modelo de Bohr utilizaba un número cuántico(n) para definir una órbita, el modelo de Schrödinger utiliza tres números cuánticos para describir un orbital: n, l y ml . A continuación vemos las características de estos números:
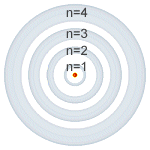
- Número cuántico principal (n):Representa al nivel de energía (estado estacionario de Bohr) y su valor es un número entero positivo (1, 2, 3, 4, etc) y se le asocia a la idea física del volumen del orbital. Dicho de otra manera el número cuántico principal determina el tamaño de las órbitas, por tanto, la distancia al núcleo de un electrón vendrá determinada por este número cuántico. Todas las órbitas con el mismo número cuántico principal forman una capa. Su valor puede ser cualquier número natural mayor que 0 (1, 2, 3...) y dependiendo de su valor, cada capa recibe como designación una letra. Si el número cuántico principal es 1, la capa se denomina K, si 2 L, si 3 M, si 4 N, si 5 P, etc.
- Número cuántico secundario (l):Identifica al subnivel de energía del electrón y se le asocia a la forma del orbital. Sus valoresdependen del número cuántico principal "n", es decir, sus valores son todos los enteros entre 0 y (n-1), incluyendo al 0. Ejemplo: n = 4 ; l = 0, 1, 2, 3. Dicho de otra manera, El número cuántico azimutal determina la excentricidad de la órbita, cuanto mayor sea, más excéntrica será, es decir, más aplanada será la elipse que recorre el electrón. Su valor depende del número cuántico principal n, pudiendo variar desde 0 hasta una unidad menos que éste(desde 0 hasta n-1). Así, en la capa K, como n vale 1, l sólo puede tomar el valor 0, correspondiente a una órbita circular. En la capa M, en la que n toma el valor de 3, l tomará los valores de 0, 1 y 2, el primero correspondiente a una órbita circular y los segundos a órbitas cada vez más excéntricas.
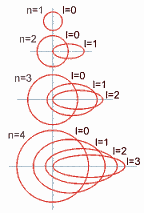
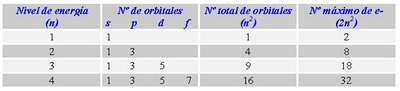
- Número cuántico magnético (m): Describe las orientaciones espaciales de los orbitales. Sus valores son todos los enteros del intervalo (-l,+l) incluyendo el 0.Ejemplo: n = 4, entonces, l = 0, 1, 2, 3m = -3, -2, -1, 0, +1, +2, +3. Dicho de otra manera, El número cuántico magnético determina la orientación espacial de las órbitas, de las elipses. Su valor dependerá del número de elipses existente y varía desde -l hasta l, pasando por el valor 0. Así, si el valor de l es 2, las órbitas podrán tener 5 orientaciones en el espacio, con los valores de m -2, -1, 0, 1 y 2. Si el número cuántico azimutal es 1, existen tres orientaciones posible (-1, 0 y 1), mientras que si es 0, sólo hay una posible orientación espacial, correspondiente al valor de m 0.
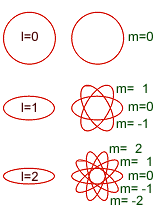
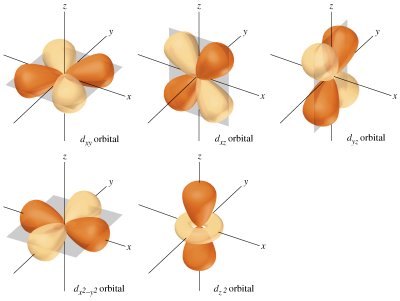
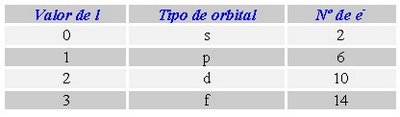
El conjunto de estos tres números cuánticos determinan la forma y orientación de la órbita que describe el electrón y que se denomina orbital. Según el número cuántico azimutal (l), el orbital recibe un nombre distinto. cuando l = 0, se llama orbital s; si vale 1, se denomina orbital p, cuando I=2 se denomina orbital d, si su valor es 3, se denomina orbital f, si 4 g, y así sucesivamente. Pero no todas las capa tienen el mismo número de orbitales, el número de orbitales depende de la capa y, por tanto, del número cuántico n. Así, en la capa K, como n = 1, l sólo puede tomar el valor 0 (desde 0 hasta n-1, que es 0) y m también valdrá 0 (su valor varía desde -l hasta l, que en este caso valen ambos 0), así que sólo hay un orbital s, de valores de números cuánticos (1,0,0). En la capa M, en la que n toma el valor 3. El valor de l puede ser 0, 1 y 2. En el primer caso (l = 0), m tomará el valor 0, habrá un orbital s; en el segundo caso (l = 1), m podrá tomar los valores -1, 0 y 1 y existirán 3 orbitales p; en el caso final (l = 2) m tomará los valores -2, -1, 0, 1 y 2, por lo que hay 5 orbitales d. En general, habrá en cada capa n2 orbitales, el primero s, 3 serán p, 5 d, 7 f, etc.
- Número cuántico de espín (s): Describe el giro del electrón en torno a su propio eje, en un movimiento de rotación. Este giro puede hacerlo sólo en dos direcciones, opuestas entre sí. Por ello, los valores que puede tomar el número cuántico de spin son -1/2 y +1/2. Dicho de otra manera, Cada electrón, en un orbital, gira sobre si mismo. Este giro puede ser en el mismo sentido que el de su movimiento orbital o en sentido contrario. Este hecho se determina mediante un nuevo número cuántico, el número cuántico se spin s, que puede tomar dos valores, 1/2 y -1/2.

Según el principio de exclusión de Pauli, en un átomo no pueden existir dos electrones con los cuatro números cuánticos iguales, así que en cada orbital sólo podrán colocarse dos electrones (correspondientes a los valores de s +1/2 y -1/2) y en cada capa
podrán situarse
 electrones (dos en cada orbital).
electrones (dos en cada orbital).El rayado Electrónico
TALLER : 1) a) Realice la distribución electrónica de los 10 primeros elementos químicos.
b) Dibuje cada átomo anterior ubicando sus orbitales ( nombres y electrones).

_page-0019.jpg)
_page-0020.jpg)
_page-0021.jpg)
_page-0040.jpg)
_page-0041.jpg)
_page-0042.jpg)
_page-0043.jpg)
_page-0044.jpg)
_page-0045.jpg)
_page-0046.jpg)
_page-0047.jpg)
_page-0048.jpg)
_page-0049.jpg)
_page-0050.jpg)
_page-0051.jpg)
_page-0052.jpg)












.jpg)











.jpg)
.png)








.jpg)
